Kế hoạch giáo dục môn Hóa học Lớp 11 - THPT Phạm Văn Đồng
1 SỰ ĐIỆN LI 1-Hiện tượng điện li
2-Phân loại các chất điện li Kiến thức
Biết được :
Khái niệm về sự điện li, chất điện li, chất điện li mạnh, chất điện li yếu, cân bằng điện li.
Kĩ năng
Quan sát thí nghiệm, rút ra được kết luận về tính dẫn điện của dung dịch chất điện li.
Phân biệt được chất điện li, chất không điện li, chất điện li mạnh, chất điện li yếu.
Viết được phương trình điện li của chất điện li mạnh, chất điện li yếu. 1
(3)
- Phát hiện và giải quyết vấn đề.( Dạy học nêu vấn đề)
-Dạy học hợp tác (thảo luận nhóm).
- Sử dụng các phương tiện trực quan (thí nghiệm, thiết bị dạy học .)
- Đàm thoại tìm tòi. ( Đàm thoại nêu vấn đề, gợi mở)
- iếp cận tươngT tự theo cấp độ (“Hãy làm như tôi làm”)
Bạn đang xem 20 trang mẫu của tài liệu "Kế hoạch giáo dục môn Hóa học Lớp 11 - THPT Phạm Văn Đồng", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Kế hoạch giáo dục môn Hóa học Lớp 11 - THPT Phạm Văn Đồng
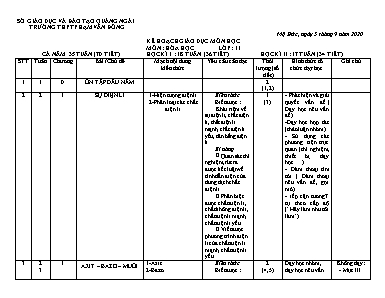
SỞ GIÁO DỤC VÀ ĐÀO TẠO QUẢNG NGẢI TRƯỜNG THPT PHẠM VĂN ĐỒNG Mộ Đức , ngày 5 tháng 9 năm 2020 KẾ HOẠCH GIÁO DỤC MÔN HỌC MÔN : HÓA HỌC LỚP : 11 CẢ NĂM 35 TUẦN (70 TIẾT) HỌC KÌ I : 18 TUẦN (36 TIẾT) HỌC KÌ II : 17 TUẦN (34 TIẾT) STT Tuần Chương Bài /Chủ đề Mạch nội dung kiến thức Yêu cầu cần đạt Thời lượng (số tiết) Hình thức tổ chức dạy học Ghi chú 1 1 0 ÔN TẬP ĐẦU NĂM 2 (1,2) 2 2 1 SỰ ĐIỆN LI 1-Hiện tượng điện li 2-Phân loại các chất điện li Kiến thức Biết được : Khái niệm về sự điện li, chất điện li, chất điện li mạnh, chất điện li yếu, cân bằng điện li. Kĩ năng - Quan sát thí nghiệm, rút ra được kết luận về tính dẫn điện của dung dịch chất điện li. - Phân biệt được chất điện li, chất không điện li, chất điện li mạnh, chất điện li yếu. - Viết được phương trình điện li của chất điện li mạnh, chất điện li yếu. 1 (3) - Phát hiện và giải quyết vấn đề.( Dạy học nêu vấn đề) -Dạy học hợp tác (thảo luận nhóm). - Sử dụng các phương tiện trực quan (thí nghiệm, thiết bị dạy học.) - Đàm thoại tìm tòi. ( Đàm thoại nêu vấn đề, gợi mở) - iếp cận tươngT tự theo cấp độ (“Hãy làm như tôi làm”) 3 2 3 1 AXIT – BAZƠ – MUỐI 1-Axit 2-Bazơ 3-Hiđroxit lưỡng tính 4-Muối Kiến thức Biết được : - Định nghĩa : axit, bazơ, hiđroxit lưỡng tính và muối theo thuyết A-rê-ni-ut. - Axit một nấc, axit nhiều nấc, muối trung hoà, muối axit. Kĩ năng - Phân tích một số thí dụ về axit, bazơ, muối cụ thể, rút ra định nghĩa. - Nhận biết được một chất cụ thể là axit, bazơ, muối, hiđroxit lưỡng tính, muối trung hoà, muối axit theo định nghĩa. - Viết được phương trình điện li của các axit, bazơ, muối, hiđroxit lưỡng tính cụ thể. - Tính nồng độ mol ion trong dung dịch chất điện li mạnh. 2 (4,5) Dạy học nhóm, dạy học nêu vấn đề. Không dạy: - Mục III. Hidroxit lưỡng tín (Sn(OH)2, Pb(OH)2) - Bài tập 2, phần d 4 3 1 SỰ ĐIỆN LI CỦA NƯỚC. PH. CHẤT CHỈ THỊ AXIT-BAZƠ 1-Nước là chất điện li rất yếu 2-Khái niệm về PH . Chất chỉ thị axit –bazơ Kiến thức Biết được: - Tích số ion của nước, ý nghĩa tích số ion của nước. - Khái niệm về pH, định nghĩa môi trường axit, môi trường trung tính và môi trường kiềm. - Chất chỉ thị axit - bazơ : quỳ tím, phenolphtalein và giấy chỉ thị vạn năng Kĩ năng - Tính pH của dung dịch axit mạnh, bazơ mạnh. - Xác định được môi trường của dung dịch bằng cách sử dụng giấy chỉ thị vạn năng, giấy quỳ tím hoặc dung dịch phenolphtalein. 1 (6) - Phát hiện và giải quyết vấn đề. - Sử dụng các phương tiện trực quan (thí nghiệm, TBDH, tranh ảnh ), SGK. -Đàm thoại tìm tòi. -Sử dụng câu hỏi bài tập. -Hoạt động nhóm Tự học có hướng dẫn : Mục II. 2. Chất chỉ thị axit - bazơ 5 4 1 PHẢN ỨNG TRAO ĐỔI ION TRONG DUNG DỊCH CÁC CHẤT ĐIỆN LI. 1-Điều kiện xảy ra phản ứng trao đổi ion trong dung dịch các chất điện li 2-Kết luận Kiến thức: Hiểu được: - Bản chất của phản ứng xảy ra trong dung dịch các chất điện li là phản ứng giữa các ion. - Để xảy ra phản ứng trao đổi ion trong dung dịch các chất điện li phải có ít nhất một trong các điều kiện: + Tạo thành chất kết tủa. + Tạo thành chất điện li yếu. + Tạo thành chất khí. Kĩ năng: - Quan sát hiện tượng thí nghiệm để biết có phản ứng hóa học xảy ra. - Dự đoán kết quả phản ứng trao đổi ion trong dung dịch các chất điện li. - Viết được phương trình ion đầy đủ và rút gọn. - Tính khối lượng kết tủa hoặc thể tích khí sau phản ứng; tính % khối lượng các chất trong hỗn hợp; tính nồng độ mol ion thu được sau phản ứng. 1 (7) Dạy học nhóm, dạy học nêu vấn đề. 6 4 5 1 LUYỆN TẬP AXIT , BAZƠ,VÀ MUỐI PHẢN ỨNG TRAO ĐỔI ION TRONG DUNG DỊCH CÁC CHẤT ĐIỆN LI 1-Axit 2-Bazơ 3-Hiđroxit lưỡng tính 4-Muối 5-Tích số ion của nước 6-PH 7-Chất chỉ thị 8-Phản ứng trao đổi ion 9-Phương trình ion rút gọn Kiến thức Củng cố các kiến thức về axit, bazơ, muối và khái niệm pH của dung dịch. Củng cố kiến thức về phản ứng trao đổi ion xảy ra trong dung dịch chất điện li. Kỹ năng Rèn luyện kỹ năng viết phương trình phản ứng trao đổi giữa các chất điện li dạng đầy đủ và dạng ion thu gọn. Vận dụng kiến thức để dự đoán chiều hướng của phản ứng trao đổi giữa các chất điện li và làm một số dạng bài tập cơ bản. 1 (8,9) Đàm thoại nêu vấn đề kết hợp với hệ thống bài tập. 7 5 1 THỰC HÀNH TÍNH AXIT – BAZƠ PHẢN ỨNG TRAO ĐỔI ION TRONG DUNG DỊCH CÁC CHẤT ĐIỆN LI 1-TN1 : Tính axit –bazơ 2-TN2: Phản ứng trao đổi ion trong dung dịch các chất điện li Kiến thức Biết được : Mục đích, cách tiến hành và kĩ thuật thực hiện các thí nghiệm : - Tác dụng của các dung dịch HCl, CH3COOH, NaOH, NH3 với chất chỉ thị màu. - Phản ứng trao đổi ion trong dung dịch các chất điện li : AgNO3 với NaCl, HCl với NaHCO3, CH3COOH với NaOH. Kĩ năng - Sử dụng dụng cụ, hoá chất để tiến hành được thành công, an toàn các thí nghiệm trên. - Quan sát hiện tượng thí nghiệm, giải thích và rút ra nhận xét. - Viết tường trình thí nghiệm. 1 (10) Dạy học nhóm, các nhóm làm TN theo sự hướng dẫn của GV . 8 6 2 NITƠ 1-Vị trí và cấu hình e nguyên tử 2-Tính chất vật lí 3-Tính chất hóa học 4-Ứng dụng 5-Trạng thái tự nhiên 6-Điều chế Kiến thức Biết được: - Vị trí trong bảng tuần hoàn , cấu hình electron nguyên tử của nguyên tố nitơ. - Cấu tạo phân tử, tính chất vật lí (trạng thái, màu, mùi, tỉ khối, tính tan), ứng dụng chính, trạng thái tự nhiên; điều chế nitơ trong phòng thí nghiệm và trong công nghiệp Hiểu được: - Phân tử nitơ rất bền do có liên kết ba, nên nitơ khá trơ ở nhiệt độ thường, nhưng hoạt động hơn ở nhiệt độ cao. - Tính chất hoá học đặc trưng của nitơ: tính oxi hoá (tác dụng với kim loại mạnh, với hiđro), ngoài ra nitơ còn có tính khử (tác dụng với oxi). Kĩ năng - Dự đoán tính chất, kiểm tra dự đoán và kết luận về tính chất hoá học của nitơ. - Viết các PTHH minh hoạ tính chất hoá học. - Tính thể tích khí nitơ ở đktc trong phản ứng hoá học; tính % thể tích nitơ trong hỗn hợp khí. 1 (11) Dạy học nhóm, dạy học nêu vấn đề. *Tự học có hướng dẫn: Mục II. Tính chất vật lí Mục V. Trạng thái tự nhiên Mục VI.1. Trong công nghiệp * Không dạy: Mục VI.2. Trong phòng thí nghiệm 9 6 7 2 AMONIAC VÀ MUỐI AMONI A-Amoniac 1-Cấu tạo phân tử 2-Tính chất vật lí 3-Tính chất hóa học 4-Ứng dụng 5-Điều chế B-Muối amoni 1-Tính chất vật lí 2-Tính chất hóa học A. Amoniac Kiến thức Biết được: - Cấu tạo phân tử, tính chất vật lí (tính tan, tỉ khối, màu, mùi), ứng dụng chính, cách điều chế amoniac trong phòng thí nghiệm và trong công nghiệp . Hiểu được: - Tính chất hoá học của amoniac: Tính bazơ yếu ( tác dụng với nước, dung dịch muối, axit) và tính khử (tác dụng với oxi, clo). Kĩ năng - Dự đoán tính chất hóa học, kiểm tra bằng thí nghiệm và kết luận được tính chất hoá học của amoniac. - Quan sát thí nghiệm hoặc hình ảnh..., rút ra được nhận xét về tính chất vật lí và hóa học của amoniac. - Viết được các PTHH dạng phân tử hoặc ion rút gọn. - Phân biệt được amoniac với một số khí đã biết bằng phương pháp hoá học. - Tính thể tích khí amoniac sản xuất được ở đktc theo hiệu suất.phản ứng B-Muối amoni: Kiến thức Biết được: - Tính chất vật lí (trạng thái, màu sắc, tính tan). - Tính chất hoá học (phản ứng với dung dịch kiềm, phản ứng nhiệt phân) và ứng dụng Kĩ năng - Quan sát thí nghiệm, rút ra được nhận xét về tính chất của muối amoni. - Viết được các PTHH dạng phân tử, ion thu gọn minh hoạ cho tính chất hoá học. - Phân biệt được muối amoni với một số muối khác bằng phương pháp hóa học. Tính % về khối lượng của muối amoni trong hỗn hợp. 2 (12,13) Dạy học nhóm, dạy học nêu vấn đề. * Không dạy: Hình 2.2. Sơ đồ cấu tạo của phân tử NH3 * Mục III.2.b. Tác dụng với clo Thay bằng PTHH: 4NH3 + 5O2 → (dòng 1 trang 41) 10 7 8 2 AXIT NITRIC VÀ MUỐI NITRAT A-Axit nitric 1-Cấu tạo phân tử 2-Tính chất vật lí 3-Tính chất hóa học 4-Ứng dụng 5-Điều chế B-Muối nitrat 1-Tính chất của muối nitrat 2-Ứng dụng C.Chu trình của nitơ trong tự nhiên A. Axit nitric Kiến thức Biết được: Cấu tạo phân tử, tính chất vật lí (trạng thái, màu sắc, khối lượng riêng, tính tan), ứng dụng, cách điều chế HNO3 trong phòng thí nghiệm và trong công nghiệp (từ amoniac). Hiểu được : - HNO3 là một trong những axit mạnh nhất. - HNO3 là chất oxi hoá rất mạnh: oxi hoá hầu hết kim loại, một số phi kim, nhiều hợp chất vô cơ và hữu cơ. Kĩ năng - Dự đoán tính chất hóa học, kiểm tra dự đoán bằng thí nghiệm và rút ra kết luận. - Quan sát thí nghiệm, hình ảnh..., rút ra được nhận xét về tính chất của HNO3. - Viết các PTHH dạng phân tử, ion rút gọn minh hoạ tính chất hoá học của HNO3 đặc và loãng. - Tính thành phần % khối lượng của hỗn hợp kim loại tác dụng với HNO3. B.Muối nitrat: Kiến thức: Biết được: - Phản ứng đặc trưng của ion NO3- với Cu trong môi trường axit. - Cách nhận biết ion NO3 – bằng phương pháp hóa học. Chu trình của nitơ trong tự nhiên. Kĩ năng: - Quan sát thí nghiệm, rút ra được nhận xét về tính chất của muối nitrat. - Viết được các PTHH dạng phân tử và ion thu gọn minh hoạ cho tính chất hoá học. - Tính thành phần % khối lượng muối nitrat trong hỗn hợp; nồng độ hoặc thể tích dung dịch muối nitrat tham gia hoặc tạo thành trong phản ứng . 3 (14,15,16) Dạy học nhóm, dạy học nêu vấn đề. * Không dạy: Mục B.I.3. Nhận biết ion nitrat * Khuyến khích học sinh tự đọc: Mục C. Chu trình của nitơ trong tự nhiên 11 9 KIỂM TRA GIỮA KÌ I 1 (17) 12 9 2 PHOTPHO 1-Vị trí và cấu hình e nguyên tử 2-Tính chất vật lí 3-Tính chất hóa học 4-Ứng dụng 5-Trạng thái tự nhiên 6-Sản xuất Kiến thức Biết được: - Vị trí trong bảng tuần hoàn , cấu hình electron nguyên tử của nguyên tố photpho. - Các dạng thù hình, tính chất vật lí (trạng thái, màu sắc, khối lượng riêng, tính tan, độc tính), ứng dụng, trạng thái tự nhiên và điều chế photpho trong công nghiệp . Hiểu được: - Tính chất hoá học cơ bản của photpho là tính oxi hoá (tác dụng với kim loại Na, Ca...) và tính khử (tác dụng với O2, Cl2). Kĩ năng: - Dự đoán, kiểm tra bằng thí nghiệm và kết luận về tính chất của photpho. - Quan sát thí nghiệm, hình ảnh .., rút ra được nhận xét về tính chất của photpho. - Viết được PTHH minh hoạ. - Sử dụng được photpho hiệu quả và an toàn trong phòng thí nghiệm và thực tế 1 (18) Dạy học nhóm, dạy học nêu vấn đề. * Mục II. Tính chất vật lí : Không dạy cấu trúc của photpho trắng, photpho đỏ và các hình 2.10; 2.11 13 10 2 AXIT PHOTPHORIC VÀ MUỐI PHOTPHAT A-Axit photphoric 1-Cấu tạo phân tử 2-Tính chất vật lí 3-Tính chất hóa học 4-Điều chế 5-Ứng dụng B-Muối photphat 1-Tính tan 2-Nhận biết ion photphat Kiến thức Biết được: - Cấu tạo phân tử, tính chất vật lí (trạng thái, màu, tính tan), ứng dụng, cách điều chế H3PO4 trong phòng thí nghiệm và trong công nghiệp. - Tính chất của muối photphat (tính tan, tác dụng với axit, phản ứng với dung dịch muối khác), ứng dụng. Hiểu được H3PO4 là axit trung bình, axit ba nấc. Kĩ năng: - Viết các PTHH dạng phân tử hoặc ion rút gọn minh hoạ tính chất của axit H3PO4 và muối photphat. - Nhận biết được axit H3PO4 và muối photphat bằng phương pháp hoá học. - Tính khối lượng H3PO4 sản xuất được, % muối photphat trong hỗn hợp. 1 (19) Dạy học nhóm, dạy học nêu vấn đề. * Khuyến khích học sinh tự đọc: Mục A.IV.1. Trong phòng thí nghiệm * Phần muối nitrat: Không dạy phản ứng nhận biết ion nitrat 14 10 2 PHÂN BÓN HÓA HỌC 1-Phân đạm 2-Phân lân 3-Phân kali 4-Phân hỗn hợp và phân phức hợp Kiến thức Biết được: - Khái niệm phân bón hóa học và phân loại - Tính chất, ứng dụng, điều chế phân đạm, lân, kali, NPK và vi lượng. Kĩ năng - Quan sát mẫu vật, làm thí nghiệm nhận biết một số phân bón hóa học. - Sử dụng an toàn, hiệu quả một số phân bón hoá học. - Tính khối lượng phân bón cần thiết để cung cấp một lượng nguyên tố dinh dưỡng 1 (20) + Vấn đáp, thuyết trình, nêu và giải quyết vấn đề,... + Phương pháp góc, sơ đồ tư duy, thảo luận nhóm,... 15 11 2 LUYỆN TẬP : TÍNH CHẤT CỦA NITƠ , PHOTPHO VÀ HỢP CHẤT CỦA CHÚNG 1 (21) Không yêu cầu học sinh viết PTHH (1) và (2) của bài tập 3 16 11 2 THỰC HÀNH TÍNH CHẤT CỦA MỘT SỐ HỢP CHẤT NITƠ, PHOTPHO 1 (22) Không làm Thí nghiệm 3.b 17 12 3 CACBON Kiến thức Nêu được : -Vị trí cacbon trong bảng tuần hoàn, cấu hình lớp electron ngoài cùng của cacbon. -Các dạng thù hình của cacbon , cấu trúc và tính chất vật lí của các dạng thù hình đó. -Tính chất hóa học cơ bản của cacbon là tính oxi hóa và tính khử. Trong đó cơ bản là tính khử ở nhiệt độ cao và số oxi hóa thường có của cacbon trong hợp chất là +2 , +4 hoặc -4. - Trạng thái tự nhiên của C và phương pháp điều chế một số dạng thù hình của C trong công nghiệp. -Vai trò của C đối với đời sống và sản xuất. Kĩ năng -Đọc, tóm tắt thông tin về tính chất vật lý, các dạng thù hình của C, ứng dụng và trạng thái tự nhiên của C. -Giải thích tính chất dựa vào đặc điểm cấu trúc tinh thể của các dạng thù hình. - Dự đoán tính chất hóa học của C dựa trên kiến thức về cấu tạo nguyên tử, các số oxi hóa của C. Viết ptpư minh họa. - Quan sát thí nghiệm, hình ảnh...rút ra được nhận xét về tính chất, điều chế. -Giải thích được 1 số vấn đề có liên quan về cacbon trong thực tế. - Biết sử dụng các dạng thù hình của cacbon trong các mục đích khác nhau. 1 (23) Dạy học nhóm, dạy học phát vấn, nêu vấn đề. *Khuyến khích học sinh tự đọc: -Mục II.3. Fuleren - Mục VI. Điều chế * Tự học có hướng dẫn: -Mục IV. Ứng dụng -Mục V. Trạng thái tự nhiên 18 12 13 3 HỢP CHẤT CỦA CACBON A-Cacbon monooxit 1-Tính chất vật lí 2-Tính chất hóa học 3-Điều chế B-Cacbon đioxit 1-Tính chất vật lí 2-Tính chất hóa học 3-Điều chế C-Axit cacbonic và muối cacbonat 1- Axit cacbonic 2- Muối cacbonat Kiến thức - Giải thích và minh họa được tính chất hóa học của hợp chất của các cacbon: + CO có tính khử mạnh (tác dụng với oxi, clo, oxit kim loại); + CO2 là một oxit axit, có tính oxi hoá yếu (tác dụng với Mg, C) + H2CO3 là axit yếu, hai nấc, không bền dựa vào hằng số cân bằng Kc. + Tính chất hoá học của muối cacbonat (nhiệt phân, tác dụng với axit, với dung dịch kiềm) - Liệt kê được các phương pháp điều chế khí CO2, CO trong công nghiệp (phương pháp khí lò ga, khí than ướt) - Nêu được thành phần hoá học, ứng dụng của một số muối cacbonat quan trọng. Kỹ năng Viết được CTCT của CO, CO2. - Suy đoán tính chất hợp chất từ cấu tạo phân tử (số oxi hoá), kiểm tra và kết luận. - Thực hiện một số thí nghiệm, quan sát hình ảnh thí nghiệm, rút ra nhận xét. - Viết các phương trình hóa học minh hoạ tính chất hoá học của CO, CO2, muối cacbonat. - Giải được bài tập: tính thành phần phần trăm về khối lượng của muối cacbonat trong hỗn hợp; tính thành phần phần trăm khối lượng oxit kim loại trong hỗn hợp phản ứng với CO; bài tập về tính khử của CO đối với hỗn hợp oxyt kim loại, CO2 tác dụng với dung dịch kiềm theo những tỷ lệ mol khác nhau. 2 (24,25) Chia nhóm, nêu tình huống giải quyết vấn đề kết hợp với đàm thoại diễn giảng. 19 13 3 SILIC VÀ HỢP CHẤT CỦA SILIC A-Silic 1-Tính chất vật lí 2-Tính chất hóa học 3-Trạng thái tự nhiên 4-Ứng dụng 5-Điều chế B-Hợp chất của silic 1-Silic đioxit 2-Axit silixic 3-Muối silicat Kiến thức Biết được: - Vị trí của silic trong bảng tuần hoàn các nguyên tố hoá học, cấu hình electron nguyên tử. - Tính chất vật lí (dạng thù hình, cấu trúc tinh thể, màu sắc, chất bán dẫn), trạng thái tự nhiên , ứng dụng (trong kĩ thuật điện), điều chế silic (Mg + SiO2). - Tính chất hoá học : Là phi kim hoạt động hoá học yếu, ở nhiệt độ cao tác dụng với nhiều chất (oxi, cacbon, dung dịch NaOH, magie). - SiO2: Tính chất vật lí (cấu trúc tinh thể, tính tan), tính chất hoá học (tác dụng với kiềm đặc, nóng, với dung dịch HF). - H2SiO 3 : Tính chất vật lí (tính tan, màu) sắc, tính chất hoá học ( là axit yếu, ít tan trong nước, tan trong kiềm nóng). Kĩ năng - Viết được các PTHH thể hiện tính chất của silic và các hợp chất của nó. - Bảo quản, sử dụng được hợp lí, an toàn, hiệu quả vật liệu thuỷ tinh, đồ gốm, xi măng. - Tính % khối lượng SiO2 trong hỗn hợp. 1 (26) -Đàm thoại nêu vấn đề. -Đàm thoại tìm tòi kết hợp thí nghiệm, hình ảnh. -Phương pháp nhóm. -Phương pháp trực quan. -Phương pháp giải quyết vấn đề. -Phương pháp tìm hiểu mạng. *Tự học có hướng dẫn: -Mục I. Tính chất vật lí của silic -Mục III. Trạng thái tự nhiên của silic - Phản ứng khắc chữ lên thủy tinh 20 14 3 LUYỆN TẬP CACBON , SILIC VÀ HỢP CHẤT 1 (27) 21 14 15 3 MỞ ĐẦU VỀ HÓA HỌC HỮU CƠ - THÀNH PHẦN NGUYÊN TỐ VÀ CÔNG THỨC PHÂN TỬ 1-Khái niệm về hợp chất hữu cơ và hóa học hữu cơ 2-Phân loại hợp chất hữu cơ 3-Đặc điểm chung của hợp chất hữu cơ 4-Sơ lược về phân tích nguyên tố Kiến thức Biết được : - Khái niệm hoá học hữu cơ và hợp chất hữu cơ, đặc điểm chung của các hợp chất hữu cơ. - Phân loại hợp chất hữu cơ theo thành phần nguyên tố (hiđrocacbon và dẫn xuất). - Các loại công thức của hợp chất hữu cơ : Công thức chung, công thức đơn giản nhất, công thức phân tử và công thức cấu tạo. - Sơ lược về phân tích nguyên tố : Phân tích định tính, phân tích định lượng. Kĩ năng - Tính được phân tử khối của chất hữu cơ dựa vào tỉ khối hơi. - Xác định được công thức phân tử khi biết các số liệu thực nghiệm. - Phân biệt được hiđrocacbon và dẫn xuất của hiđrocacbon theo thành phần phân tử. 2 (28,29) -Trực quan , suy diễn , quy nạp , nêu vấn đề -Phương pháp dạy học hợp tác. -Phương pháp đàm thoại tìm tòi. -Phương pháp sử dụng câu hỏi bài tập. 22 15 16 4 CẤU TRÚC PHÂN TỬ HỢP CHẤT HỮU CƠ 1-Công thức cấu tạo 2-Thuyết cấu tạo hóa học 3-Đồng đẳng , đồng phân 4-Liên kết hóa học và cấu trúc phân tử hợp chất hữu cơ Kiến thức Biết được : - Nội dung thuyết cấu tạo hoá học ; Khái niệm đồng đẳng, đồng phân. - Liên kết cộng hoá trị và khái niệm về cấu trúc không gian của phân tử chất hữu cơ. Kĩ năng - Viết được công thức cấu tạo của một số chất hữu cơ cụ thể. - Phân biệt được chất đồng đẳng, chất đồng phân dựa vào công thức cấu tạo cụ thể. 2 (30,31) Diễn giảng , đàm thoại , tổ chức nhóm. 23 16 17 4 LUYỆN TẬP HỢP CHẤT HỮU CƠ , CÔNG THỨC PHÂN TỬ VÀ CÔNG THỨC CẤU TẠO 2 (32,33) 24 17 18 ÔN TẬP CUỐI HỌC KÌ I 2 (34,35) 25 18 KIỂM TRA CUỐI HỌC KÌ I 1 (36) 26 19 5 ANKAN 1-Đồng đẳng , đồng phân , danh pháp 2-Tính chất vật lí 3-Tính chất hóa học 4-Điều chế 5-Ứng dụng Kiến thức Biết được : - Định nghĩa hiđrocacbon, hiđrocacbon no và đặc điểm cấu tạo phân tử của chúng. - Công thức chung, đồng phân mạch cacbon, đặc điểm cấu tạo phân tử và danh pháp. - Tính chất vật lí chung (quy luật biến đổi về trạng thái, nhiệt độ nóng chảy, nhiệt độ sôi, khối lượng riêng, tính tan). - Tính chất hoá học (phản ứng thế, phản ứng cháy, phản ứng tách hiđro, phản ứng crăckinh). - Phương pháp điều chế metan trong phòng thí nghiệm và khai thác các ankan trong công nghiệp. ứng dụng của ankan. Kĩ năng - Quan sát thí nghiệm, mô hình phân tử rút ra được nhận xét về cấu trúc phân tử, tính chất của ankan. - Viết được công thức cấu tạo, gọi tên một số ankan đồng phân mạch thẳng, mạch nhánh. - Viết các phương trình hoá học biểu diễn tính chất hoá học của ankan. - Xác định công thức phân tử, viết công thức cấu tạo và gọi tên. - Tính thành phần phần trăm về thể tích và khối lượng ankan trong hỗn hợp khí, tính nhiệt lượng của phản ứng cháy. 2 (37,38) Dạy học nhóm, dạy học nêu vấn đề. 27 20 5 LUYỆN TẬP ANKAN 2 (39,40) 28 21 THỰC HÀNH PHÂN TÍCH ĐỊNH TÍNH NGUYÊN TỐ ĐIỀU CHẾ VÀ TÍNH CHẤT CỦA METAN Kiến thức Biết được : Mục đích, cách tiến hành, kĩ thuật thực hiện các thí nghiệm cụ thể. - Phân tích định tính các nguyên tố C và H. - Điều chế và thu khí metan. - Đốt cháy khí metan. - Dẫn khí metan vào dung dịch thuốc tím. Kĩ năng - Sử dụng dụng cụ, hoá chất để tiến hành được an toàn, thành công các thí nghiệm trên. - Quan sát, mô tả hiện tượng, giải thích và viết các phương trình hoá học. - Viết tường trình thí nghiệm. 1 (41) *Không làm : Thí nghiệm 2: Điều chế và thử tính chất của metan 29 21 22 6 ANKEN 1-Đồng đẳng , đồng phân , danh pháp 2-Tính chất vật lí 3-Tính chất hóa học 4-Điều chế 5-Ứng dụng Kiến thức Biết được : - Công thức chung, đặc điểm cấu tạo phân tử, đồng phân cấu tạo và đồng phân hình học. - Cách gọi tên thông thường và tên thay thế của anken. - Tính chất vật lí chung (quy luật biến đổi về nhiệt độ nóng chảy, nhiệt độ sôi, khối lượng riêng, tính tan) của anken. - Phương pháp điều chế anken trong phòng thí nghiệm và trong công nghiệp. ứng dụng. - Tính chất hoá học : Phản ứng cộng brom trong dung dịch, cộng hiđro, cộng HX theo quy tắc Mac-côp-nhi-côp ; phản ứng trùng hợp ; phản ứng oxi hoá. Kĩ năng - Quan sát thí nghiệm, mô hình rút ra được nhận xét về đặc điểm cấu tạo và tính chất. - Viết được công thức cấu tạo và tên gọi của các đồng phân tương ứng với một công thức phân tử (không quá 6 nguyên tử C trong phân tử). - Viết các phương trình hoá học của một số phản ứng cộng, phản ứng trùng hợp cụ thể. - Phân biệt được một số anken với ankan cụ thể. - Xác định công thức phân tử, viết công thức cấu tạo, gọi tên anken. - Tính thành phần phần trăm về thể tích trong hỗn hợp khí có một anken cụ thể. 2 (42,43) - Phương pháp thuyết trình, hỏi đáp. - Phương pháp nhóm. Tự học có hướng dẫn: -Mục tính chất vật lý của anken, - Mục ứng dụng của anken 30 22 6 ANKAĐIEN 1-Định nghĩa và phân loại 2-Tính chất hóa học Kiến thức Biết được : - Định nghĩa, công thức chung, đặc điểm cấu tạo của ankađien. - Đặc điểm cấu tạo, tính chất hoá học của ankađien liên hợp (buta-1,3-đien và isopren : phản ứng cộng 1, 2 và cộng 1, 4). Điều chế buta-1,3-đien từ butan hoặc butilen và isopren từ isopentan trong công nghiệp. Kĩ năng - Quan sát được thí nghiệm, mô hình phân tử, rút ra nhận xét về cấu tạo và tính chất của ankađien - Viết được công thức cấu tạo của một số ankađien cụ thể. - Dự đoán được tính chất hoá học, kiểm tra và kết luận. - Viết được các phương trình hoá học biểu diễn tính chất hoá học của buta-1,3-đien 1 (44) - Phương pháp thuyết trình, hỏi đáp. - Phương pháp nhóm. Tự học có hướng dẫn: - Mục ứng dụng của ankađien 31 23 6 LUYỆN TẬP ANKEN VÀ ANKAĐIEN 2 (45,46) 24 6 ANKIN-LUYỆN TẬP 1-Đồng đẳng , đồng phân , danh pháp 2-Tính chất vật lí 3-Tính chất hóa học 4-Điều chế 5-Ứng dụng 6-Luyện tập Kiến thức Biết được : - Định nghĩa, công thức chung, đặc điểm cấu tạo, đồng phân, danh pháp, tính chất vật lí (quy luật biến đổi về trạng thái, nhiệt độ nóng chảy, nhiệt độ sôi, khối lượng riêng, tính tan) của ankin. - Tính chất hoá học của ankin : Phản ứng cộng H2, Br2, HX ; Phản ứng thế nguyên tử H linh động của ank-1-in ; phản ứng oxi hoá). Điều chế axetilen trong phòng thí nghiệm và trong công nghiệp. Kĩ năng - Quan sát được thí nghiệm, mô hình phân tử, rút ra nhận xét về cấu tạo và tính chất của ankin. - Viết được công thức cấu tạo của một số ankin cụ thể. - Dự đoán được tính chất hoá học, kiểm tra và kết luận. - Viết được các phương trình hoá học biểu diễn tính chất hoá học của axetilen. - Phân biệt ank-1-in với anken bằng phương pháp hoá học. - Tính thành phần phần trăm về thể tích khí trong hỗn hợp. 2 (47,48) Phương pháp dạy học nhóm, dạy học nêu vấn đề. Tự học có hướng dẫn: -Mục tính chất vật lý của ankin, - Mục ứng dụng của ankin 32 25 6 THỰC HÀNH ĐIỀU CHẾ VÀ TÍNH CHẤT CỦA ETILEN, AXETILEN 1 (49) Chia nhóm thực hành _Tích hợp khi dạy chủ đề hiđrocacbon không no và có thể sử dụng video thí nghiệm 1 Không yêu cầu làm thí nghiệm 2 33 25 26 7 BENZEN VÀ ĐỒNG ĐẲNG 1-Đồng đẳng , đồng phân , danh pháp, cấu tạo 2-Tính chất vật lí 3-Tính chất hóa học Kiến thức Biết được : - Định nghĩa, công thức chung, đặc điểm cấu tạo, đồng phân, danh pháp. - Tính chất vật lí : Quy luật biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của các chất trong dãy đồng đẳng benzen. - Tính chất hoá học : Phản ứng thế (quy tắc thế), phản ứng cộng vào vòng benzen ; Phản ứng thế và oxi hoá mạch nhánh. Kĩ năng - Viết được công thức cấu tạo của benzen và một số chất trong dãy đồng đẳng. - Viết được các phương trình hoá học biểu diễn tính chất hoá học của benzen, vận dụng quy tắc thế để dự đoán sản phẩm phản ứng. - Xác định công thức phân tử, viết công thức cấu tạo và gọi tên. - Tính khối lượng benzen, toluen tham gia phản ứng hoặc thành phần phần trăm về khối lượng của chất trong hỗn hợp. 2 (50,51) Phương pháp dạy học nhóm, dạy học nêu vấn đề. *Không dạy: Mục B.II. Naphtalen 34 26 7 LUYỆN TẬP HIĐROCACBON THƠM 1 (52) 35 27 7 HỆ THỐNG HÓA VỀ HIĐROCACBON Kiến thức Biết được : Mối quan hệ giữa các loại hiđrocacbon quan trọng. Kĩ năng - Lập được sơ đồ quan hệ giữa các loại hiđrocacbon. - Viết được các phương trình hoá học biểu diễn mối quan hệ giữa các chất. - Tách chất ra khỏi hỗn hợp khí, hỗn hợp lỏng. - Xác định công thức phân tử, viết công thức cấu tạo và gọi tên. 1 (53) 36 27 8 KIỂM TRA GIỮA HỌC KÌ II 1 (54) 37 28 8 ANCOL 1-Định nghĩa , phân loại 2-Đồng phân , danh pháp 3-Tính chất vật lí 4-Tính chất hóa học 5-Điều chế 6-Ứng dụng Kiến thức Biết được : - Định nghĩa, phân loại ancol. - Công thức chung, đặc điểm cấu tạo phân tử, đồng phân, danh pháp (gốc - chức và thay thế). - Tính chất vật lí : Nhiệt độ sôi, độ tan trong nước ; Liên kết hiđro. - Tính chất hoá học : Phản ứng của nhóm -OH (thế H, thế -OH), phản ứng tách nước tạo thành anken hoặc ete, phản ứng oxi hoá ancol bậc I, bậc II thành anđehit, xeton ; Phản ứng cháy. - Phư ơng pháp điều chế ancol từ anken, điều chế etanol từ tinh bột, điều chế glixerol. - ứng dụng của etanol. - Công thức phân tử, cấu tạo, tính chất riêng của glixerol (phản ứng với Cu(OH)2). Kĩ năng - Viết được công thức cấu tạo các đồng phân ancol. - Đọc được tên khi biết công thức cấu tạo của các ancol (có 4C - 5C). - Dự đoán được tính chất hoá học của một số ancol đơn chức cụ thể. - Viết được phương trình hoá học minh hoạ tính chất hoá học của ancol và glixerol. - Phân biệt được ancol no đơn chức với glixerol bằng phương pháp hoá học. - Xác định công thức phân tử, công thức cấu tạo của ancol. 2 (55,56) Phương pháp dạy học nhóm, dạy học nêu vấn đề. * Tự học có hướng dẫn: Mục: V.1.a; V.2 * Không dạy: Mục V.1.b 38 29 8 LUYỆN TẬP ANCOL 1-Kiến thức cần nắm vững 2-Bài tập 1 (57,58) Đàm thoại ,hoạt động nhóm làm bài tạp 39 30 8 PHENOL 1-Định nghĩa –Phân loại 2-Phenol Kiến thức Biết được : - Khái niệm, phân loại phenol. - Tính chất vật lí : Trạng thái, nhiệt độ sôi, nhiệt độ nóng chảy, tính tan. - Tính chất hoá học : Tác dụng với natri, natri hiđroxit, nước brom. - Một số phương pháp điều chế phenol (từ cumen, từ benzen) ; ứng dụng của phenol. - Khái niệm về ảnh hưởng qua lại giữa các nguyên tử trong phân tử hợp chất hữu cơ. Kĩ năng - Phân biệt dung dịch phenol với ancol cụ thể bằng phương pháp hoá học. - Viết các phương trình hoá học minh hoạ tính chất hoá học của phenol. - Tính khối lượng phenol tham gia và tạo thành trong phản ứng. 1 (59) Phương pháp thuyết trình, hỏi đáp. * Khuyến khích học sinh tự đọc: Mục I.2. Phân loại * Không dạy: Mục II.4. Điều chế 40 30 8 LUYỆN TẬP ANCOL-PHENOL 1 (60) Không yêu cầu học sinh làm : Bài tập 2; Bài tập 5 (b) 41 31 8 THỰC HÀNH TÍNH CHẤT CỦA ETANOL, GLIXEROL VÀ PHENOL Kiến thức Biết được : Mục đích, cách tiến hành, kĩ thuật thực hiện các thí nghiệm : - Etanol tác dụng với natri. - Glixerol tác dụng với Cu(OH)2. - Phenol tác dụng với NaOH, dung dịch brom. Kĩ năng - Sử dụng dụng cụ, hoá chất để tiến hành được an toàn, thành công các thí nghiệm trên. - Quan sát, mô tả hiện tượng, giải thích và viết các phương trình hoá học. - Viết tường trình thí nghiệm. - Viết tường trình thí nghiệm. 1 (61) Chia nhóm làm thực hành 42 31 32 9 ANDEHIT - XETON A-Anđehit 1-Định nghĩa , phân loại, danh pháp 2-Đặc điểm cấu tạo , tính chất vật lí 3-Tính chất hóa học 4-Điều chế 5-Ứng dụng B-Xeton Kiến thức Biết được : - Định nghĩa, phân loại, danh pháp của anđehit. - Đặc điểm cấu tạo phân tử của anđehit. - Tính chất vật lí : Trạng thái, nhiệt độ sôi, nhiệt độ nóng chảy, tính tan. - Tính chất hoá học của anđehit no đơn chức (đại diện là anđehit axetic) : Tính khử (tác dụng với dung dịch bạc nitrat trong amoniac), tính oxi hoá (tác dụng với hiđro). - Phư ơng pháp điều chế anđehit từ ancol bậc I, điều chế trực tiếp anđehit fomic từ metan, anđehit axetic từ etilen. Một số ứng dụng chính của anđehit. - Sơ lược về xeton (đặc điểm cấu tạo, tính chất, ứng dụng chính). Kĩ năng - Dự đoán được tính chất hoá học đặc trưng của anđehit và xeton ; Kiểm tra dự đoán và kết luận. - Quan sát thí nghiệm, hình ảnh và rút ra nhận xét về cấu tạo và tính chất. - Viết các phương trình hoá học minh hoạ tính chất hoá học của anđehit fomic và anđehit axetic, axeton. - Nhận biết anđehit bằng phản ứng hoá học đặc trưng. - Tính khối lượng hoặc nồng độ dung dịch anđehit trong phản ứng. 2 (62,63) Dạy học thuyết trình , đàm thoại , gợi mở , tìm tòi .nêu và giải quyết vấn đề . - Mục A.III.2. Không dạy phản ứng oxi hóa anđehit bởi O2 - Mục B. Xeton: Không dạy 43 32 33 9 AXIT CACBOXYLIC 1-Định nghĩa , phân loại , danh pháp 2-Đặc điểm cấu tạo 3-Tính chất vật lí 4-Tính chất hóa học 5-Điều chế 6-Ứng dụng Kiến thức Biết được : - Định nghĩa, phân loại, đặc điểm cấu tạo phân tử, danh pháp. - Tính chất vật lí : Nhiệt độ sôi, độ tan trong nước ; Liên kết hiđro. - Tính chất hoá học : Tính axit yếu (phân li thuận nghịch trong dung dịch, tác dụng với bazơ, oxit bazơ, muối của axit yếu hơn, kim loại hoạt động mạnh), tác dụng với ancol tạo thành este. Khái niệm phản ứng este hoá. - Phương pháp điều chế, ứng dụng của axit cacboxylic. Kĩ năng - Quan sát thí nghiệm, mô hình, rút ra được nhận xét về cấu tạo và tính chất. - Dự đoán được tính chất hoá học của axit cacboxylic no, đơn chức, mạch hở. - Viết các phương trình hoá học minh hoạ tính chất hoá học. - Phân biệt axit cụ thể với ancol, phenol bằng phương pháp hoá học. - Tính khối lượng hoặc nồng độ dung dịch axit trong phản ứng. 2 (64,6
File đính kèm:
 ke_hoach_giao_duc_mon_hoa_hoc_lop_11_thpt_pham_van_dong.docx
ke_hoach_giao_duc_mon_hoa_hoc_lop_11_thpt_pham_van_dong.docx

