Đề kiểm tra học kì I môn Hoá 9 - Năm học 2021-2022 - Đề 2 (Có đáp án)
Câu 2: Oxit lưỡng tính là:
A. Những oxit tác dụng với dung dịch axit tạo thành muối và nước.
B. Những oxit tác dụng với dung dịch bazơ và tác dụng với dung dịch axit tạo thành muối và nước.
C. Những oxit tác dụng với dung dịch bazơ tạo thành muối và nước.
D. Những oxit chỉ tác dụng được với muối.
Câu 3: Chất tác dụng với nước tạo ra dung dịch bazơ là:
A. CO2,
B. Na2O
C. SO2,
D. P2O5
Câu 4:Nhóm chất tác dụng với nước và với dung dịch HCl là:
A. Na2O, SO3, CO2 .
B. K2O, P2O5, CaO.
C. BaO, SO3, P2O5.
D. CaO, BaO, Na2O.
Bạn đang xem tài liệu "Đề kiểm tra học kì I môn Hoá 9 - Năm học 2021-2022 - Đề 2 (Có đáp án)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Đề kiểm tra học kì I môn Hoá 9 - Năm học 2021-2022 - Đề 2 (Có đáp án)
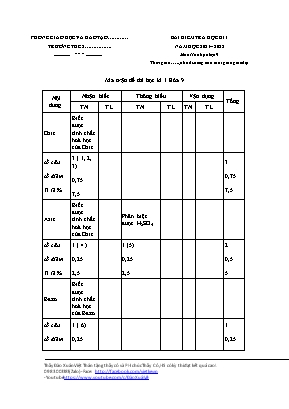
PHÒNG GIÁO DỤC VÀ ĐÀO TẠO TRƯỜNG THCS . ................ * * * ................ BÀI KIỂM TRA HỌC KÌ I NĂM HỌC 2021– 2022 Môn Hóa học lớp 9 Thời gian: . phút (không tính thời gian giao đề) Ma trận đề thi học kì 1 Hóa 9 Nội dung Nhận biết Thông hiểu Vận dụng Tổng TN TL TN TL TN TL Oxit Biết được tính chất hoá học của Oxit số câu số điểm Tỉ lệ % 3 ( 1, 2, 3) 0,75 7,5 3 0,75 7,5 Axit Biết được tính chất hoá học của Oxit Phân biệt được H2SO4 số câu số điểm Tỉ lệ % 1 ( 4 ) 0,25 2,5 1 (5) 0,25 2,5 2 0,5 5 Bazơ Biết được tính chất hoá học của Bazơ số câu số điểm Tỉ lệ % 1 ( 6) 0,25 2,5 1 0,25 2,5 Muối Phân biệt được 2 muối số câu số điểm Tỉ lệ % 1( 7) 0,25 2,5 1 0,25 2,5 Kim loại Biết được ứng dụng của kim loại dựa vào tính chất vật lí Hiểu được dãy HĐHH, tính chất hoá học của kim loại Tính được thành phần % của hỗn hợp 2 kim loại số câu số điểm Tỉ lệ % 1 ( 8) 0,25 2,5 4( 9,10,11,12) 1 10 1 ( 3) 3 30 6 4,25 42,5 Mối quan hệ giữa các loại hợp chất hữu cơ Phân biệt một số hợp chất hữu cơ Viết PTHH biểu diễn chuỗi phản ứng số câu số điểm Tỉ lệ % 1 ( 2) 1,5 15 1( 1) 2,5 25 2 4 40 Tổng số câu số điểm Tỉ lệ % 6 1,5 15 1 1,5 15 6 1,5 15 1 2,5 25 1 3 30 15 10 100 Đề thi Hóa 9 học kì 1 I. PHẦN TRẮC NGHIỆM ( 3 đ ) Khoanh tròn vào chữ cái trước đáp án đúng Câu 1: Chất tác dụng với nước tạo ra dung dịch axit là: A. CaO, B. BaO, C. Na2O D. SO3. Câu 2: Oxit lưỡng tính là: Những oxit tác dụng với dung dịch axit tạo thành muối và nước. Những oxit tác dụng với dung dịch bazơ và tác dụng với dung dịch axit tạo thành muối và nước. Những oxit tác dụng với dung dịch bazơ tạo thành muối và nước. Những oxit chỉ tác dụng được với muối. Câu 3: Chất tác dụng với nước tạo ra dung dịch bazơ là: A. CO2, B. Na2O C. SO2, D. P2O5 Câu 4:Nhóm chất tác dụng với nước và với dung dịch HCl là: Na2O, SO3, CO2 . K2O, P2O5, CaO. BaO, SO3, P2O5. CaO, BaO, Na2O. Câu 5: Thuốc thử dùng để nhận biết dung dịch HCl và dung dịch H2SO4 là: A. K2SO4 B. Ba(OH)2 C. NaCl D. NaNO3 Câu 6. Bazơ tan và không tan có tính chất hoá học chung là: Làm quỳ tím hoá xanh Tác dụng với oxit axit tạo thành muối và nước Tác dụng với axit tạo thành muối và nước Bị nhiệt phân huỷ tạo ra oxit bazơ và nước Câu 7: Nếu chỉ dùng dung dịch NaOH thì có thể phân biệt được 2 dung dịch muối nào trong mỗi cặp chất sau: A.Na2SO4 và Fe2(SO4)3 B Na2SO4 và K2SO4 C. Na2SO4và BaCl2 D. Na2CO3 và K3PO4 Câu 8: Kim loại được dùng làm đồ trang sức vì có ánh kim rất đẹp, đó là các kim loại: A. Ag, Cu. B. Au, Pt. C . Au, Al. D. Ag, Al. Câu 9: Đơn chất tác dụng với dung dịch H2SO4 loãng giải phóng khí Hiđro là: AĐồng B. Lưu huỳnh C. Kẽm D. Thuỷ ngân Câu 10: Nhôm hoạt động hoá học mạnh hơn sắt, vì: Al, Fe đều không phản ứng với HNO3đặc nguội. Al có phản ứng với dung dịch kiềm. Nhôm đẩy được sắt ra khỏi dung dịch muối sắt. Chỉ có sắt bị nam châm hút. Câu 11: Có một mẫu Fe bị lẫn tạp chất là nhôm, để làm sạch mẫu sắt này bằng cách ngâm nó với? Dung dịch NaOH dư Dung dịch H2SO4loãng Dung dịch HCl dư Dung dịch HNO3loãng . Câu 12: Nhôm phản ứng được với : Khí clo, dung dịch kiềm, axit, khí oxi. Khí clo, axit, oxit bazo, khí hidro. Oxit bazơ, axit, hiđro, dung dịch kiềm Khí clo, axit, oxi, hiđro, dung dịch magiesunfat II. PHẦN TỰ LUẬN Câu 1:( 2,5đ) Hoàn thành chuçi phản ứng hóa học sau? FeFeCl3 →Fe(OH)3→Fe2O3→Fe2(SO4)3→FeCl3 Câu 2: (1,5đ) Có 3 lọ đựng các dung dịch bị mất nhãn sau: NaCl, Na2SO4, NaOH. Bằng phương pháp hoá học hãy nhận biết các dung dịch trên. Viết phương trình hoá học. Câu 3: (3đ) Cho 30g hỗn hợp hai kim loại sắt và đồng tác dụng với dd HCl dư. Sau khi phản ứng xong thu được chất rắn A và 6,72l khí (ở đktc) a. Viết phương trình phản ứng hóa học xảy ra. b. Tính thành phần trăm theo khối lượng của hỗn hợp ban đầu. Đáp án đề thi Hóa 9 học kì 1 I. PHẦN TRẮC NGHIỆM ( 3 đ) Mỗi ý đúng 0,25đ Câu 1 2 3 4 5 6 7 8 9 10 11 12 Đáp án D B B D B C A B C C A A II. PHẦN TỰ LUẬN ( 7 đ) Câu 1: Mổi phương trình đúng 0,5đ (1) 2Fe + 3Cl2 → 2FeCl3 (2) FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl (3) 2Fe(OH)3 → Fe2O3 + 3H2O (4) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O (5) Fe2(SO4)3 + 3BaCl2→ 3BaSO4 + 2FeCl3 Câu 2: Trích mẫu thử, đánh số thứ tự. Nhỏ mỗi chất trên vào quỳ tím chuyển màu xanh là NaOH. 0,5 đ Nhận biết 2 muối bằng cách cho tác dụng với BaCl2 dung dịch nào phản ứng xuất hiện chất không tan màu trắng là Na2SO4, còn lại là NaCl. 0,5 đ PTHH: Na2SO4 + BaCl2 → BaSO4 + 2NaCl 0,5 đ Câu 3: nH2 = 6,72:22,4 = 0,3 mol 0,5 đ PTHH: Fe + 2HCl → FeCl2 + H2 0,5đ Theo PT 1 mol : 1 mol Theo đb 0,3 mol : 0,3 mol 0,5đ mFe = 0,3.56 = 16,8 g 0,5đ %Fe = 16,8x100 : 30 = 56 % 0,5đ %Cu = 100 – 56 = 44% 0,5đ * Hướng dẫn học sinh tự học ở nhà: - Về nhà chuẩn bị trước bài mới “Axit cacbonic và muối cacbonat”
File đính kèm:
 de_kiem_tra_hoc_ki_i_mon_hoa_9_nam_hoc_2021_2022_de_2_co_dap.doc
de_kiem_tra_hoc_ki_i_mon_hoa_9_nam_hoc_2021_2022_de_2_co_dap.doc

