Kế hoạch giáo dục môn Hóa học Lớp 10 - THPT Phạm Văn Đồng
ÔN TẬP ĐẦU NĂM 1-Nguyên tử
2-Nguyên tố hóa học
3-Hóa trị của 1 nguyên tố
4-Định luật bảo toàn khối lượng
5-Mol
6-Tỉ khối của chất khí
7-Dung dịch
8-Sự phân loại các hợp chất vô cơ
9-Bảng tuần hoàn các nguyên tố hóa học Kiến thức:Giúp học sinh tái hiện và củng cố lại các kiến thức cơ bản đã học ở THCS
Kỹ năng: Giúp học sinh tự giải quyết một số các bài tập liên quan. 2
(1,2) Vấn đáp, đàm thoại, hoàn thiện kiến thức đã học.
Bạn đang xem 20 trang mẫu của tài liệu "Kế hoạch giáo dục môn Hóa học Lớp 10 - THPT Phạm Văn Đồng", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Kế hoạch giáo dục môn Hóa học Lớp 10 - THPT Phạm Văn Đồng
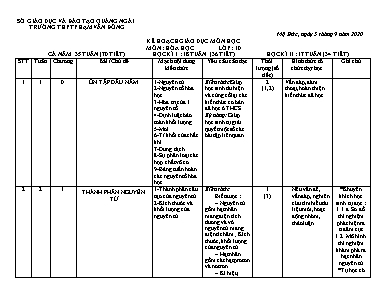
SỞ GIÁO DỤC VÀ ĐÀO TẠO QUẢNG NGẢI TRƯỜNG THPT PHẠM VĂN ĐỒNG Mộ Đức , ngày 5 tháng 9 năm 2020 KẾ HOẠCH GIÁO DỤC MÔN HỌC MÔN : HÓA HỌC LỚP : 10 CẢ NĂM 35 TUẦN (70 TIẾT) HỌC KÌ I : 18 TUẦN (36 TIẾT) HỌC KÌ II : 17 TUẦN (34 TIẾT) STT Tuần Chương Bài /Chủ đề Mạch nội dung kiến thức Yêu cầu cần đạt Thời lượng (số tiết) Hình thức tổ chức dạy học Ghi chú 1 1 0 ÔN TẬP ĐẦU NĂM 1-Nguyên tử 2-Nguyên tố hóa học 3-Hóa trị của 1 nguyên tố 4-Định luật bảo toàn khối lượng 5-Mol 6-Tỉ khối của chất khí 7-Dung dịch 8-Sự phân loại các hợp chất vô cơ 9-Bảng tuần hoàn các nguyên tố hóa học Kiến thức:Giúp học sinh tái hiện và củng cố lại các kiến thức cơ bản đã học ở THCS Kỹ năng: Giúp học sinh tự giải quyết một số các bài tập liên quan. 2 (1,2) Vấn đáp, đàm thoại, hoàn thiện kiến thức đã học. 2 2 1 THÀNH PHẦN NGUYÊN TỬ 1-Thành phần cấu tạo của nguyên tử 2-Kích thước và khối lượng của nguyên tử Kiến thức Biết được : - Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử mang điện tích âm ; Kích thước, khối lượng của nguyên tử. - Hạt nhân gồm các hạt proton và nơtron. - Kí hiệu, khối lượng và điện tích của electron, proton và nơtron. Kĩ năng - So sánh khối lượng của electron với proton và nơtron. - So sánh kích thước của hạt nhân với electron và với nguyên tử. 1 (3) Nêu vấn đề, vấn đáp, nghiên cứu tìm hiểu tài liệu mới, hoạt động nhóm , thảo luận *Khuyến khích học sinh tự đọc : I.1.a. Sơ đồ thí nghiệm phát hiện ra tia âm cực I.2. Mô hình thí nghiệm khám phá ra hạt nhân nguyên tử *Tự học có hướng dẫn : II. Kích thước và khối lượng của nguyên tử *Không yêu cầu học sinh làm bài tập 5 3 2 3 1 HẠT NHÂN NGUYÊN TỬ - NGUYÊN TỐ HÓA HỌC – ĐỒNG VỊ 1-Hạt nhân nguyên tử 2-Nguyên tố hóa học 3-Đồng vị 4-Nguyên tử khối và nguyên tử khối trung bình của các nguyên tố hóa học Kiến thức Hiểu được : - Nguyên tố hoá học bao gồm những nguyên tử có cùng số đơn vị điện tích hạt nhân. - Số hiệu nguyên tử (Z) bằng số đơn vị điện tích hạt nhân và bằng số electron có trong nguyên tử. - Kí hiệu nguyên tử : là kí hiệu hoá học của nguyên tố, số khối (A) là tổng số hạt proton và số hạt nơtron. - Khái niệm đồng vị, nguyên tử khối và nguyên tử khối trung bình của một nguyên tố. Kĩ năng - Xác định số electron, số proton, số nơtron khi biết kí hiệu nguyên tử ngược lại. - Tính nguyên tử khối trung bình của nguyên tố có nhiều đồng vị. 2 (4,5) Nêu vấn đề, vấn đáp, nghiên cứu tìm hiểu tài liệu mới, hoạt động nhóm, thảo luận 4 3 1 LUYỆN TẬP THÀNH PHẦN NGUYÊN TỬ 1. Nguyên tử được cấu tạo bởi electron và hạt nhân. Hạt nhân được cấu tạo bởi proton và notron. 2. Trong nguyên tử số đvđthn Z = số p = số e. + Số khối A = Z + N . Nt khối là giá trị gần đúng của giá trị này. + NT khối của một nguyên tố nhiều đồng vị = N tkhối TB của các đồng vị đó. + Nguyên tố hoá học là những nguyên tử có cùng Z. + Các đồng vị của một nguyên tố hoá học là các nguyên tử có cùng Z mà khác N (A). 3. Số khối A và số hiệu Z đặc trưng cho nguyên tử: kí hiệu nguyên tử: . Kiến thức: Học sinh hiểu và vận dụng các kiến thức: Thành phần cấu tạo nguyên tử. Kỹ năng: * Xác định số e, p, n và nguyên tử khối khi biết kí hiệu nguyên tử. * Xác định nguyên tử khối trung bình của các nguyên tố hoá học. 1 (6,7) Hoạt động nhóm, thảo luận 5 4 1 CẤU TẠO VỎ NGUYÊN TỬ 1-Sự chuyển động của các e trong nguyên tử 2-Lớp e và phân lớp e 3-Số e tối đa trong 1 phân lớp , 1 lớp Kiến thức Biết được: - Các electron chuyển động rất nhanh xung quanh hạt nhân nguyên tử không theo những quỹ đạo xác định, tạo nên vỏ nguyên tử. - Trong nguyên tử, các electron có mức năng lượng gần bằng nhau được xếp vào một lớp (K, L, M, N). - Một lớp electron bao gồm một hay nhiều phân lớp. Các electron trong mỗi phân lớp có mức năng lượng bằng nhau. - Số electron tối đa trong một lớp, một phân lớp. Kĩ năng Xác định được thứ tự các lớp electron trong nguyên tử, số phân lớp (s, p, d) trong một lớp. 1 (8) Hình thức dạy học nhóm, dạy học nêu vấn đề. 6 4 5 1 CẤU HÌNH ELECTRON CỦA NGUYÊN TỬ 1-Thứ tự các mức năng lượng trong nguyên tử 2-Cấu hình e của nguyên tử 3- Đặc điểm của lớp e ngoài cùng Kiến thức Biết được: - Thứ tự các mức năng lượng của các electron trong nguyên tử. - Sự phân bố electron trên các phân lớp, lớp và cấu hình electron nguyên tử của 20 nguyên tố đầu tiên. - Đặc điểm của lớp electron ngoài cùng: Lớp ngoài cùng có nhiều nhất là 8 electron (ns2np6), lớp ngoài cùng của nguyên tử khí hiếm có 8 electron (riêng heli có 2 electron). Hầu hết các nguyên tử kim loại có 1, 2, 3 electron ở lớp ngoài cùng. Hầu hết các nguyên tử phi kim có 5, 6, 7 electron ở lớp ngoài cùng. Kĩ năng - Viết được cấu hình electron nguyên tử của một số nguyên tố hoá học. - Dựa vào cấu hình electron lớp ngoài cùng của nguyên tử suy ra tính chất hoá học cơ bản (là kim loại, phi kim hay khí hiếm) của nguyên tố tương ứng. 2 (9,10) Hình thức dạy học nhóm, dạy học nêu vấn đề. 7 5 6 1 LUYỆN TẬP - CẤU TẠO VỎ NGUYÊN TỬ 1-Lớp và phân lớp e 2-Mối liên hệ giữa lớp e ngoài cùng với loại nguyên tố Kiến thức: Học sinh nắm vững: + Vỏ nguyên tử gồm các lớp và phân lớp electron. +Các mức năng lượng của lớp, phân lớp. Số electron tối đa trong một lớp, một phân lớp. +Cấu hình electron của nguyên tử. 2 .Kỹ năng:HS được rèn luyện về một số dạng bài tập liên quan đến cấu hình electron lớp ngoài cùng của nguyên tử. Từ cấu hình electron của nguyên tử suy ra tính chất tiêu biểu của nguyên tố. 2 (11,12) Dạy học nhóm, dạy học nêu vấn đề. 9 7 2 BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HOÁ HỌC 1-Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn 2-Cấu tạo của BTH các nguyên tố hóa học Kiến thức Biết được: - Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn. - Cấu tạo của bảng tuần hoàn: ô, chu kì, nhóm nguyên tố (nhóm A, nhóm B). Kĩ năng Từ vị trí trong bảng tuần hoàn của nguyên tố (ô, nhóm, chu kì) suy ra cấu hình electron và ngược lại. 2 (13,14) Dạy học nhóm, dạy học nêu vấn đề, hướng dẫn HS tự xây dựng bài và rút ra kết luận. *Tự học có hướng dẫn: Mục II. 1. Ô nguyên tố Mục II. 2. Chu kì 10 8 2 SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN TỐ HOÁ HỌC 1-Sự biến đổi tuần hoàn cấu hình e nguyên tử của các nguyên tố 2-Cấu hình e nguyên tử của các nguyên tố nhóm A Kiến thức Biết được: - Đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A; - Sự tương tự nhau về cấu hình electron lớp ngoài cùng của nguyên tử (nguyên tố s, p) là nguyên nhân của sự tương tự nhau về tính chất hoá học các nguyên tố trong cùng một nhóm A; - Sự biến đổi tuần hoàn cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi số điện tích hạt nhân tăng dần chính là nguyên nhân của sự biến đổi tuần hoàn tính chất của các nguyên tố. Kĩ năng - Dựa vào cấu hình electron của nguyên tử, suy ra cấu tạo nguyên tử, đặc điểm cấu hình electron lớp ngoài cùng. - Dựa vào cấu hình electron, xác định nguyên tố s, p. 1 (15) Dạy học nhóm, dạy học nêu vấn đề. Tích hợp thành một bài: Sự biến đổi tuần hoàn cấu hình electron nguyên tử, tính chất của các nguyên tố hóa học. Định luật tuần hoàn 11 8 9 2 SỰ BIẾN ĐỔI TUẦN HOÀN TÍNH CHẤT CỦA CÁC NGUYÊN TỐ HOÁ HỌC. ĐỊNH LUẬT TUẦN HOÀN 1-Tính kim loại , tính phi kim 2-Hóa trị của các nguyên tố 3-Oxít và hiđroxit của các nguyên tố nhóm A 4-Định luật tuần hoàn Kiến thức - Biết và giải thích được sự biến đổi độ âm điện của một số nguyên tố trong một chu kì, trong nhóm A. - Hiểu được quy luật biến đổi tính kim loại, tính phi kim của các nguyên tố trong một chu kì, trong nhóm A (dựa vào bán kính nguyên tử). - Hiểu được sự biến đổi hoá trị cao nhất với oxi và hoá trị với hiđro của các nguyên tố trong một chu kì. - Biết được sự biến đổi tính axit, bazơ của các oxit và hiđroxit trong một chu kì, trong một nhóm A. - Hiểu được nội dung định luật tuần hoàn. Kĩ năng - Dựa vào qui luật chung, suy đoán được sự biến thiên tính chất cơ bản trong chu kì (nhóm A) cụ thể, thí dụ sự biến thiên về: - Độ âm điện, bán kính nguyên tử. - Hoá trị cao nhất của nguyên tố đó với oxi và với hiđro. - Tính chất kim loại, phi kim. - Công thức hoá học và tính axit, bazơ của các oxit và hiđroxit tương ứng. 2 (16,17) Dạy học nhóm, dạy học nêu vấn đề, diễn giảng – phát vấn. 12 9 2 Ý NGHĨA CỦA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HOÁ HỌC 1-Quan hệ giữa vị trí của nguyên tố và cấu tạo nguyên tử của nó 2-Quan hệ giữa vị trí và tính chất của nguyên tố 3-So sánh tính chất hóa học của một nguyên tố với các nguyên tố lân cận Kiến thức Hiểu được: Mối quan hệ giữa vị trí các nguyên tố trong bảng tuần hoàn với cấu tạo nguyên tử và tính chất cơ bản của nguyên tố và ngược lại. Kĩ năng Từ vị trí nguyên tố trong bảng tuần hoàn các nguyên tố, suy ra: - Cấu hình electron nguyên tử - Tính chất hoá học cơ bản của nguyên tố đó. - So sánh tính kim loại, phi kim của nguyên tố đó với các nguyên tố lân cận. 1 (18) Dạy học nhóm, thuyết trình đàm thoại gợi mở. 13 10 2 LUYỆN TẬP BẢNG TUẦN HOÀN, SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON CỦA NGUYÊN TỬ VÀ TÍNH CHẤT CỦA CÁC NGUYÊN TỐ HOÁ HỌC. 1-Cấu tạo bảng tuần hoàn 2-Sự biến đổi tuần hoàn 3-Định luật tuần hoàn Kiến thức:Học sinh nắm vững: * Cấu tạo bảng tuần hoàn. * Sự biến đổi tuần hoàn cấu hình electron nguyên tử các nguyên tố, tính kim loại, tính phi kim, bán kính nguyên tử, độ âm điện. * Định luật tuần hoàn. Kỹ năng: * Học sinh có kỹ năng sử dụng bảng tuần hoàn 1 (19) Hoạt động nhóm, thảo luận, vấn đáp. 14 10 2 KIỂM TRA GIỮA HỌC KÌ I 1 (20) 15 11 3 LIÊN KẾT ION. TINH THỂ ION 1-Sự hình thành ion , cation,anion 2-Sự tạo thành liên kết ion 3-Tinh thể ion Kiến thức Biết được: - Vì sao các nguyên tử lại liên kết với nhau. - Sự tạo thành ion, ion đơn nguyên tử, ion đa nguyên tử. - Định nghĩa liên kết ion. - Khái niệm tinh thể ion, tính chất chung của hợp chất ion. Kĩ năng - Viết được cấu hình electron của ion đơn nguyên tử cụ thể. - Xác định ion đơn nguyên tử, ion đa nguyên tử trong một phân tử chất cụ thể. 1 (21) Dạy học nhóm, dạy học giải quyết vấn đề. *Khuyến khích học sinh tự đọc : Tinh thể ion 16 11 12 3 LIÊN KẾT CỘNG HOÁ TRỊ 1-Sự hình thành liên kết cộng hóa trị 2-Độ âm điện và liên kết hóa học Kiến thức Biết được: - Định nghĩa liên kết cộng hoá trị, liên kết cộng hoá trị không cực (H2, O2), liên kết cộng hoá trị có cực hay phân cực (HCl, CO2). - Mối liên hệ giữa hiệu độ âm điện của 2 nguyên tố và bản chất liên kết hoá học giữa 2 nguyên tố đó trong hợp chất. - Tính chất chung của các chất có liên kết cộng hoá trị. - Quan hệ giữa liên kết cộng hoá trị không cực, liên kết cộng hoá trị có cực và liên kết ion. Kĩ năng - Viết được công thức electron, công thức cấu tạo của một số phân tử cụ thể. - Dự đoán được kiểu liên kết hoá học có thể có trong phân tử gồm 2 nguyên tử khi biết hiệu độ âm điện của chúng. 2 (22,23) Diễn giảng- đàm thoại nêu vấn đề. Kết hợp với các phương tiện trực quan, tài liệu, phiếu học tập... 17 12 13 3 LUYỆN TẬP LIÊN KẾT ION VÀ LIÊN KẾT CỘNG HÓA TRỊ 2 (24,25) 18 13 3 HOÁ TRỊ. SỐ OXI HOÁ 1-Hóa trị 2-Số oxi hóa Kiến thức Biết được: - Điện hoá trị, cộng hóa trị của nguyên tố trong hợp chất. - Số oxi hoá của nguyên tố trong các phân tử đơn chất và hợp chất. Những quy tắc xác định số oxi hoá của nguyên tố. Kĩ năng Xác định được điện hoá trị, cộng hóa trị, số oxi hoá của nguyên tố trong một số phân tử đơn chất và hợp chất cụ thể. 1 (26) Dạy học nhóm, dạy học nêu vấn đề. 19 14 3 LUYỆN TẬP LIÊN KẾT HÓA HỌC So sánh liên két ion và liên kết cộng hóa trị * Kiến thức: HS biết - Phân biệt liên kết ion, liên kết cộng hóa trị. - Biểu diễn sự hình thành liên kết cộng hóa trị, liên kết ion *Kĩ năng: HS vận dụng - Xác định hóa trị, số oxi hóa của các nguyên tố trong hợp chất. - Biểu diễn sự hình thành liên kết. 2 (27,28) Hoạt động nhóm, thảo luận, vấn đáp. Không dạy : Bảng 10. So sánh tinh thể ion, tinh thể nguyên tử, tinh thể phân tử 20 15 4 PHẢN ỨNG OXI HOÁ- KHỬ 1-Định nghĩa 2-Lập phương trình hóa học của phản ứng oxi hóa –khử 3-Ý nghĩa của phản ứng oxi hóa –khử trong thực tiển Kiến thức Hiểu được: - Phản ứng oxi hoá - khử là phản ứng hoá học trong đó có sự thay đổi số oxi hoá của nguyên tố. - Chất oxi hoá là chất nhận electron, chất khử là chất nhường electron. Sự oxi hoá là sự nhường electron, sự khử là sự nhận electron. - Các bước lập phương trình phản ứng oxi hoá - khử, - ý nghĩa của phản ứng oxi hoá - khử trong thực tiễn. Kĩ năng - Phân biệt được chất oxi hóa và chất khử, sự oxi hoá và sự khử trong phản ứng oxi hoá - khử cụ thể. - Lập được phương trình hoá học của phản ứng oxi hoá - khử dựa vào số oxi hoá (cân bằng theo phương pháp thăng bằng electron). 2 (29,30) Dạy học nhóm, dạy học nêu vấn đề. 21 16 4 PHÂN LOẠI PHẢN ỨNG TRONG HÓA HỌC VÔ CƠ 1 (31) Tự học có hướng dẫn 22 16 17 4 LUYỆN TẬP : PHẢN ỨNG OXI HÓA-KHỬ 1-Kiến thức cần năm vững 2-Bài tập Kiến thức HS biết: · Học sinh nắm vững các khái niệm: Sự khử, sự oxi hoá, chất khử, chất oxi hoá và phản ứng oxi hoá khử trên cơ sở kiến thức về cấu tạo nguyên tử, định luật tuần hoàn, liên kết hoá học và số oxi hoá. · Học sinh vận dụng: Nhận biết phản ứng oxi hố - khử cn bằng hố học của phản ứng oxi hố khử, phn loại phản ứng hố học. Kĩ năng - Củng cố và phát triển kĩ năng xác định số oxi hố của cc nguyn tố. - Củng cố và phát triển kĩ năng cân bằng phương trình hố học của phản ứng oxi hố - khử bằng phương pháp thăng bằng electron. - Rèn luyện kĩ năng nhận biết phản ứng oxi hoá - khử, chất oxi hoá, chất khử, chất tạo môi trường cho phản ứng. - Rèn luyện kĩ năng giải bài tập có tính toán đơn giản về phản ứng oxi hoá - khử. 1 (32,33) Đàm thoại Bài tập 23 17 4 BÀI THỰC HÀNH SỐ 1 PHẢN ỨNG OXI HOÁ - KHỬ Kiến thức Biết được mục đích, các bước tiến hành, kĩ thuật thực hiện của các thí nghiệm: + Phản ứng giữa kim loại và dung dịch axit, muối.. + Phản ứng oxi hoá- khử trong môi trường axit. Kĩ năng - Sử dụng dụng cụ và hoá chất để tiến hành an toàn, thành công các thí nghiệm trên. - Quan sát hiện tượng, giải thích và viết các PTHH. - Viết tường trình thí nghiệm. 1 (34) Hoạt động nhóm làm thực hành 24 18 ÔN TẬP CUỐI HỌC KÌ I 1 (35) 25 18 KIỂM TRA CUỐI HỌC KỲ 1 1 (36) 26 19 5 KHÁI QUÁT VỀ NHÓM HALOGEN 1 (37) Hướng dẫn học sinh tự học 27 19 20 5 CLO 1-Tính chất vật lí 2-Tính chất hóa học 3-Trạng thái tự nhiên 4-Ứng dụng 5-Điều chế Kiến thức Biết được: Tính chất vật lí, trạng thái tự nhiên, ứng dụng của clo, phương pháp điều chế clo trong phòng thí nghiệm, trong công nghiệp. Hiểu được: Tính chất hoá học cơ bản của clo là phi kim mạnh, có tính oxi hoá mạnh (tác dụng với kim loại, hiđro). Clo còn thể hiện tính khử . Kĩ năng - Dự đoán, kiểm tra và kết luận được về tính chất hóa học cơ bản của clo. - Quan sát các thí nghiệm hoặc hình ảnh thí nghiệm rút ra nhận xét. - Viết các phương trình hóa học minh hoạ tính chất hoá học và điều chế clo. - Tính thể tích khí clo ở đktc tham gia hoặc tạo thành trong phản ứng. 2 (38,39) Dạy học nêu vấn đề và giải quyết vấn đề.và hợp tác nhóm Tự học có hướng dẫn: Mục IV. Ứng dụng của clo 28 20 21 5 HIĐRO CLORUA - AXIT CLOHIĐRIC VÀ MUỐI CLORUA 1-Hiđro clorua 2-Axit clohiđric 3-Muối clorua và nhận biết ion clorua Kiến thức Biết được: - Cấu tạo phân tử, tính chất của hiđro clorua (tan rất nhiều trong nước tạo thành dung dịch axit clohiđric). - Tính chất vật lí, điều chế axit clohiđric trong phòng thí nghiệm và trong công nghiệp. - Tính chất, ứng dụng của một số muối clorua, phản ứng đặc trưng của ion clorua. - Dung dịch HCl là một axit mạnh, có tính khử . Kĩ năng - Dự đoán, kiểm tra dự đoán, kết luận được về tính chất của axit HCl. - Viết các PTHH chứng minh tính chất hoá học của axit HCl. - Phân biệt dung dịch HCl và muối clorua với dung dịch axit và muối khác. - Tính nồng độ hoặc thể tích của dung dịch axit HCl tham gia hoặc tạo thành trong phản ứng . 2 (40,41) Dạy học nhóm, dạy học nêu vấn đề. 29 21 5 SƠ LƯỢC VỀ HỢP CHẤT CÓ OXI CỦA CLO 1-Nước Gia-Ven 2-Clorua vôi Kiến thức Nêu được: Nước gia – ven là gì? Tính chất vật lí, tính chất hóa học, ứng dụng và điều chế nước gia – ven (trong PTN và trong CN). Clorua vôi là gì? Công thức phân tử, công thức cấu tạo, số oxi hóa của clo trong phân tử clorua vôi, tính chất vật lí, tính chất hóa học, ứng dụng và cách điều chế clorua vôi. Giải thích được: Tính oxi hóa mạnh của natri hipoclorit trong nước gia – ven và tính oxi hóa mạnh của clorua vôi (có tính sát trùng , tẩy trắng sợi, vải, giấy, ...). Kĩ năng - Dự đoán tính chất, kiểm tra, kết luận được về tính chất hoá học của nước gia – ven và clorua vôi. - Quan sát thí nghiệm, hình ảnh...rút ra được nhận xét về tính chất, điều chế. - Viết phương trình hóa học minh hoạ tính chất và điều chế. - Tính được lượng chất cần để điều chế nước gia – ven và clorua vôi. - Giải thích được một số ứng dụng có liên quan về nước gia – ven và clorua vôi trong thực tế. 1 (42) Dạy học nhóm, dạy học nêu vấn đề. 30 22 5 FLO, BROM, IOT 1-Flo 2-Brom 3-Iot Kiến thức Biết được: Sơ lược về tính chất vật lí, trạng thái tự nhiên, ứng dụng, điều chế flo, brom, iot và một vài hợp chất của chúng. Hiểu được : Tính chất hoá học cơ bản của flo, brom, iot là tính oxi hoá, flo có tính oxi hoá mạnh nhất; nguyên nhân tính oxi hoá giảm dần từ flo đến iot. Kĩ năng - Dự đoán, kiểm tra và kết luận được tính chất hoá học cơ bản của flo, brom, iot. - Quan sát thí nghiệm, hình ảnh...rút ra được nhận xét . - Viết được các phương trình hóa học chứng minh tính chất hoá học của flo, brom, iot và tính oxi hóa giảm dần từ flo đến iot. - Tính khối lượng brom, iot và một số hợp chất tham gia hoặc tạo thành trong phản ứng. 2 (43,44) Dạy học nhóm, dạy học nêu vấn đề. Tích hợp với phần luyện tập nhóm halogen : Mục sản xuất flo, brom, iot trong công nghiệp (Bài 25) 31 23 5 LUYỆN TẬP NHÓM HALOGEN 2 (45,46) 32 24 5 THỰC HÀNH TÍNH CHẤT HOÁ HỌC CỦA KHÍ CLO VÀ HỢP CHẤT CỦA CLO 1 (47) Tích hợp khi dạy chủ đề nhóm halogen : Thí nghiệm 1, 2, 3 (bài 27) 33 24 5 THỰC HÀNH TÍNH CHẤT HOÁ HỌC CỦA BROM, IOT 1 (48) Tích hợp khi dạy chủ đề nhóm halogen : Thí nghiệm 1, 2, 3 (bài 28) 34 25 6 OXI - OZON A-Oxi 1-Vị trí cấu tạo 2-Tính chất vật lí 3-Tính chất hóa học 4-Ứng dụng 5-Điều chế B-Ozon 1-Tính chất 2-Ozon trong tự nhiên 3-Ứng dụng - Oxi: Vị trí, cấu hình lớp electron ngoài cùng; tính chất vật lí, phương pháp điều chế oxi trong phòng thí nghiệm, trong công nghiệp. - Ozon là dạng thù hình của oxi, điều kiện tạo thành ozon, ozon trong tự nhiên và ứng dụng của ozon; ozon có tính oxi hoá mạnh hơn oxi. Hiểu được: Oxi và ozon đều có tính oxi hoá rất mạnh (oxi hoá được hầu hết kim loại, phi kim, nhiều hợp chất vô cơ và hữu cơ), ứng dụng của oxi. Kĩ năng - Dự đoán tính chất, kiểm tra, kết luận được về tính chất hoá học của oxi, ozon. - Quan sát thí nghiệm, hình ảnh...rút ra được nhận xét về tính chất, điều chế. - Viết phương trình hóa học minh hoạ tính chất và điều chế. - Tính % thể tích khí oxi và ozon trong hỗn hợp 1 (49) Dạy học nhóm , thảo luận . Tự học có hướng dẫn : Mục A. Oxi 35 25 6 LƯU HUỲNH 1-Vị trí , cấu hình e nguyên tử 2-Tính chất vật lí 3-Tính chất hóa học 4-Ứng dụng của lưu huỳnh 5-Trạng thái tự nhiên và sản xuất lưu huỳnh . Kiến thức Biết được: - Vị trí, cấu hình electron lớp electron ngoài cùng của nguyên tử lưu huỳnh. - Tinh chất vật lí: Hai dạng thù hình phổ biến (tà phương, đơn tà) của lưu huỳnh, quá trình nóng chảy đặc biệt của lưu huỳnh, ứng dụng. Hiểu được: Lưu huỳnh vừa có tính oxi hoá( tác dụng với kim loại, với hiđro), vừa có tính khử (tác dụng với oxi, chất oxi hoá mạnh). Kĩ năng - Dự đoán tính chất, kiểm tra, kết luận được về tính chất hoá học của lưu huỳnh. - Quan sát thí nghiệm, hình ảnh... rút ra được nhận xét về tính chất hoá học của lưu huỳnh. - Viết phương trình hóa học chứng minh tính chất hoá học của lưu huỳnh. - Tính khối lượng lưu huỳnh, hợp chất của lưu huỳnh tham gia và tạo thành trong phản ứng. 1 (50) Dạy học nhóm , thảo luận . Không dạy: Mục II.2. Ảnh hưởng của nhiệt độ đến tính chất vật lí 36 26 KIỂM TRA GIỮA KÌ II 1 (51) THỰC HÀNH TÍNH CHẤT CỦA OXI VÀ LƯU HUỲNH(BÀI 31) *Thí nghiệm 1 (Bài 31) Tích hợp khi dạy bài 29: Oxi – Ozon * Thí nghiệm 2 (Bài 31) Không làm * Thí nghiệm 3, 4 (bài 31) Tích hợp khi dạy chủ đề: Lưu huỳnh và hợp chất của lưu huỳnh 37 26 27 6 HIĐRO SUNFUA. LƯU HUỲNH ĐIOXIT. LƯU HUỲNH TRIOXIT A-Hiđro sunfua 1-Tính chất vật lí 2-Tính chất hóa học 3-Trạng thái tự nhiên – Điều chế . B-Lưu huỳnh đioxit 1-Tính chất vật lí 2-Tính chất hóa học 3-Ứng dụng – Điều chế C-Lưu huỳnh trioxit 1-Tính chất 2-Ứng dụng và sản xuất Kiến thức Biết được: - Tính chất vật lí, trạng thái tự nhiên, tính axit yếu, ứng dụng của H2S. - Tính chất vật lí, trạng thái tự nhiên, tính chất oxit axit, ứng dụng, phương pháp điều chế SO2, SO3. Hiểu được tính chất hoá học của H2S (tính khử mạnh) và SO2 (vừa có tính oxi hoá vừa có tính khử). Kĩ năng - Dự đoán, kiểm tra, kết luận được về tính chất hoá học của H2S, SO2, SO3. - Viết phương trình hóa học minh hoạ tính chất của H2S, SO2, SO3. - Phân biệt H2S, SO2 với khí khác đã biết. - Tính % thể tích khí H2S, SO2 trong hỗn hợp. 2 (52,53) - Đàm thoại - Thảo luận nhóm - Dạy học nêu vấn đề và giải quyết vấn đề - Thực nghiệm(Thí nghiệm nghiên cứu, thí nghiệm chứng minh) 38 27 28 6 AXIT SUNFURIC- MUỐI SUNFAT A-Axit sunfuric 1-Tính chất vật lí 2-Tính chất hóa học 3-Ứng dụng 4-Sản xuất B-Muối sunfat và nhận biết ion sunfat 1- Muối sunfat 2- Nhận biết ion sunfat Kiến thức Biết được: - Công thức cấu tạo, tính chất vật lí của H2SO4, ứng dụng và sản xuất H2SO4. - Tính chất của muối sunfat, nhận biết ion sunfat. Hiểu được: - H2SO4 có tính axit mạnh ( tác dụng với kim loại, bazơ, oxit bazơ và muối của axit yếu...) - H2SO4 đặc, nóng có tính oxi hoá mạnh (oxi hoá hầu hết kim loại, nhiều phi kim và hợp chất) và tính háo nước. Kĩ năng - Quan sát thí nghiệm, hình ảnh... rút ra được nhận xét về tính chất, điều chế axit sunfuric. - Viết phương trình hóa học minh hoạ tính chất và điều chế. - Phân biệt muối sunfat , axit sunfuric với các axit và muối khác (CH3COOH, H2S ...) - Tính nồng độ hoặc khối lượng dung dịch H2SO4 tham gia hoặc tạo thành trong phản ứng. 3 (54,55,56) Dạy học nhóm, dạy học nêu vấn đề. 39 29 30 6 LUYỆN TẬP OXI – LƯU HUỲNH 3 (57,58,59) 40 30 6 THỰC HÀNH TÍNH CHẤT CÁC HỢP CHẤT CỦA LƯU HUỲNH 1 (60) *Thí nghiệm 1, 3 (bài 35): Không làm * Thí nghiệm 2, 4 (bài 35): Tích hợp khi dạy chủ đề: Lưu huỳnh và hợp chất của lưu huỳnh 41 31 7 TỐC ĐỘ PHẢN ỨNG HOÁ HỌC 1-Khái niệm về tốc độ phản ứng hóa học 2-Các yếu tố ảnh hưởng đến tốc độ phản ứng Kiến thức Biết được: - Định nghĩa tốc độ phản ứng và nêu thí dụ cụ thể. - Các yếu tố ảnh hưởng đến tốc độ phản ứng: nồng độ, áp suất, nhiệt độ, diện tích tiếp xúc, chất xúc tác. Kĩ năng - Quan sát thí nghiệm cụ thể, hiện tượng thực tế về tốc độ phản ứng, rút ra được nhận xét. - Vận dụng được các yếu tố ảnh hưởng đến tốc độ phản ứng để làm tăng hoặc giảm tốc độ của một số phản ứng trong thực tế đời sống, sản xuất theo hướng có lợi. 2 (61,62) Dạy học nhóm,dạy học nêu vấn đề. 42 32 7 CÂN BẰNG HÓA HỌC 1-Phản ứng một chiều , phản ứng thuận nghịch và cân bằng hóa học . 2-Sự chuyển dịch cân bằng hóa học 3-Các yếu tố ảnh hưởng đến cân bằng hóa học Kiến thức Biết được: - Định nghĩa phản ứng thuận nghịch và nêu thí dụ . - Khái niệm về cân bằng hoá học và nêu thí dụ. - Khái niệm về sự chuyển dịch cân bằng hoá học và nêu thí dụ. - Nội dung nguyên lí Lơ Sa- tơ- liê và cụ thể hoá trong mỗi trường hợp cụ thể. Kĩ năng - Quan sát thí nghiệm rút ra được nhận xét về phản ứng thuận nghịch và cân bằng hoá học. - Dự đoán được chiều chuyển dịch cân bằng hoá học trong những điều kiện cụ thể. - Vận dụng được các yếu tố ảnh hưởng đến cân bằng hoá học để đề xuất cách tăng hiệu suất phản ứng trong trường hợp cụ thể. 2 (63,64) Dạy học nhóm,dạy học nêu vấn đề. 43 33 7 LUYỆN TẬP : TỐC ĐỘ PHẢN ỨNG - CÂN BẰNG HÓA HỌC 1-Kiến thức cần nắm vững 2-Bài tập 2 (65,66) Hoạt động nhóm , đàm thoại, bài tập 44 34 7 THỰC HÀNH TỐC ĐỘ PHẢN ỨNG HOÁ HỌC 1 (67) Tổ chức nhóm hs làm thực hành 45 34 35 ÔN TẬP CUỐI HỌC KÌ II 2 (68,69) 46 35 KIỂM TRA CUỐI HỌC KÌ II 1 (70) Ghi chú: - Không đưa các bài tập nặng về tính toán, ít bản chất hóa học trong dạy học, thi, kiểm tra đánh giá. - Các nội dung thí nghiệm khó, độc hại hoặc cần nhiều thời gian có thể sử dụng video thí nghiệm hoặc thí nghiệm mô phỏng. TỔ TRƯỞNG CHUYÊN MÔN HIỆU TRƯỞNG (Kí , đóng dấu)
File đính kèm:
 ke_hoach_giao_duc_mon_hoa_hoc_lop_10_thpt_pham_van_dong.docx
ke_hoach_giao_duc_mon_hoa_hoc_lop_10_thpt_pham_van_dong.docx

